 数据审核管理规程.docx
数据审核管理规程.docx
《数据审核管理规程.docx》由会员分享,可在线阅读,更多相关《数据审核管理规程.docx(3页珍藏版)》请在第一文库网上搜索。
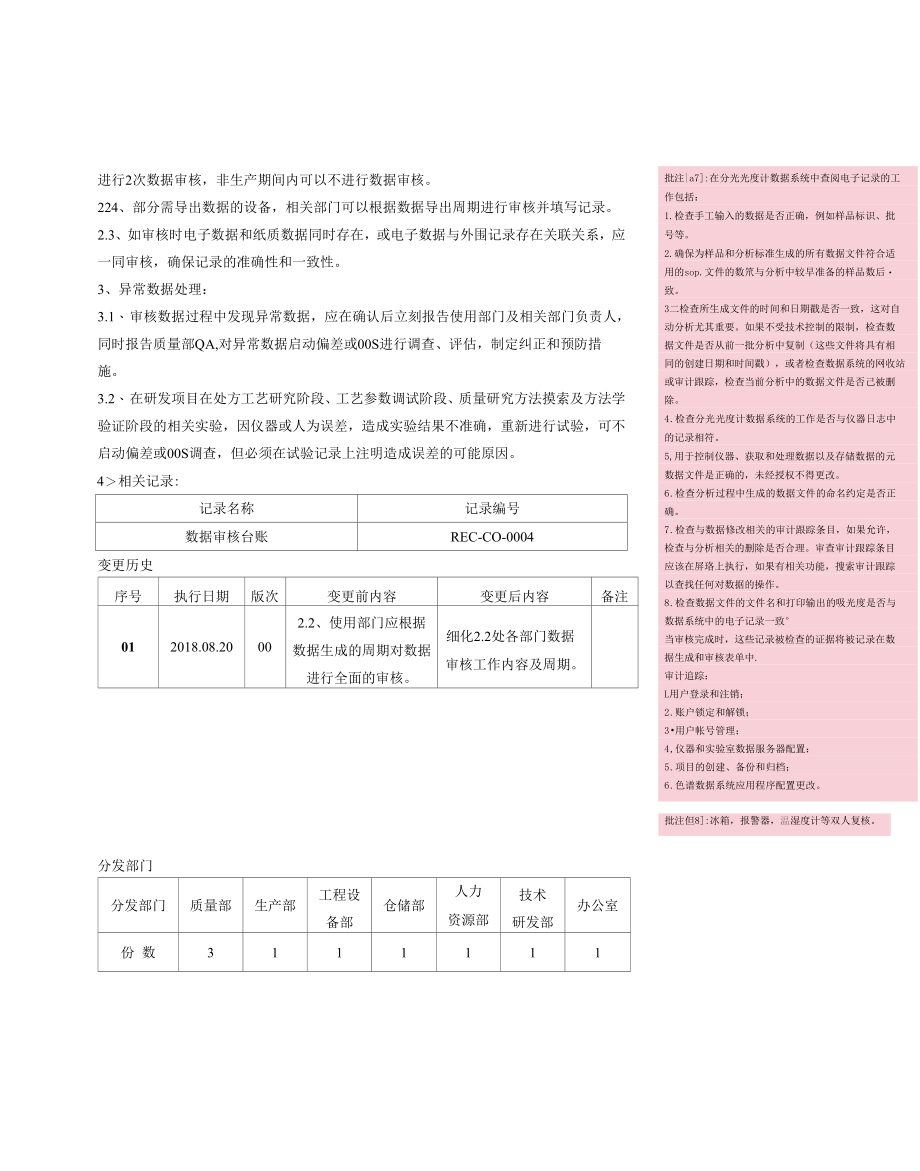
1、批注al: L数据:为参考或分析而收集的事实和统il数字。2 .动态数据:动态格式的记录,例如电子记录,允许用户和记录内容之间的交互关系。例如,数据库格式的电子记录允许用户跟踪.趋势分析和查询数据;以电子记录形式保存的色谱记录允许用户(具有适当的访问权限)对嗷据进行再处理,并放大基线以更清楚地查看积分。2最初在动态状态下捕获的信息应该在该状态下保持可用性。3 .静态数据:静态记录格式,例如纸张或pdf记录,是种固定的,允许用户和记录内容之间很少或不允许交互的格式。例如,三旦打卬或转换为静态pdf,色谱记录就失去了再处理的能力,也就失去了对基线进行更详细查看的能力。4 .数据完整性:是指数据完整
2、、三致、准确、可甲n批注|a2:数据的采集、处理、存储、生成、检索、报告等活动,应当满足相应数据类型的记录填写或数据录入的要求,保证数据真实、准确、完整和可追溯0批注(a3:谁市核审核什么内容多长时间审核一次批注(34:打印记录电子记录仪表日志,审计追踪批注但5:一般情况下,三级审核:、0C内部同级别审核,比如:操作员和操作员相互审核。建议每个批次都审核。二、QC内部高级别审核,比如:主管一级或者管路员一级审核操作员,有无违规问题。三、QC外部审核,QA审核。抽查关键批次,审?由批注准确性。第二人审查是四眼原则的重要组成部分,该原则用于所有GXP规程,以确保工作被正确地执行,结果是正确的2.有
3、效性。因此,第二人审il跟踪审查的重点应该是包含数据修改/删除细节的审计。筒而言之,第二人审查的重点是项目审计跟踪。版次01编号SMP-CO-0005-01起草:日期:数据审核管理规程审核:日期:批准:日期:总页数2生效日期:颁发部门质量部辽宁博鳌生物制药有限公司文件编号:SMP-CO-0005-01目的:通过加强对计算机化系统的数据审核,确保数据的真实、完整,异常数据可以得到及时的分析解决。I范围:适用于计算机化系统范畴内的全部电子数据与纸质数据。职责:1、使用部门负责数据的日常审核,要确保对全部数据进行审核。2、QA对数据进行抽检或全检,监督部门审核活动的有效开展。正文:1、计算机化系统的
4、数据审核应涵盖数据的有效性、一致性;内容包括电子文件中人工录入数据(主要包括自建的方法,录入的关键参数等)、系统根据设定方法及参数自动生成的数据、修改数据生成的审计追踪等信息的有效性,纸质文档与电子文档的一致性。2、计算机化系统的数据审核应建立多级的审核程序。包括部门内的过程审核、结果审核及质量部QA的审核。2.1、 操作人员将关键参数手动录入计算机化系统时,应有复核人对录入的数据进行复核,以确保其准确性。如计算机无法记录录入人员和复核人员,应建立纸质记录。只有经授权的人员才可以修改己输入的数据。(如系统本身具备审计追踪功能,应在审计追踪模块详细记录变更的理由)。2.2、 使用部门应根据数据生


- 配套讲稿:
如PPT文件的首页显示word图标,表示该PPT已包含配套word讲稿。双击word图标可打开word文档。
- 特殊限制:
部分文档作品中含有的国旗、国徽等图片,仅作为作品整体效果示例展示,禁止商用。设计者仅对作品中独创性部分享有著作权。
- 关 键 词:
- 数据 审核 管理 规程
 第一文库网所有资源均是用户自行上传分享,仅供网友学习交流,未经上传用户书面授权,请勿作他用。
第一文库网所有资源均是用户自行上传分享,仅供网友学习交流,未经上传用户书面授权,请勿作他用。



 调和油系列产品项目可行性研究报告.doc
调和油系列产品项目可行性研究报告.doc

